Procesos termodinamicos
proceso isocorico
un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante;  . Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
 ,
,
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
En un diagrama P–V, un proceso isocórico aparece como una línea vertical.
v=cte

Proceso isoborico
Un proceso isobárico es un proceso termodinámico que ocurre a presión constante. La Primera Ley de la Termodinámica, para este caso, queda expresada como sigue:
 ,
,
Donde:
 = Calor transferido.
= Calor transferido. = Energía interna.
= Energía interna. = Presión.
= Presión. = Volumen.
= Volumen.
En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.
P=cte


Proceso isotermico
Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo dicho cambio atemperatura constante en todo el sistema. La compresión o expansión de un gas ideal puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de Capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco calórico. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo. Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
Una expansión isotérmica es un proceso en el cual un gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene:
T=cte

Ya hemos visto que el volumen de un gas depende de la temperatura y la presión a la que se encuentra, de forma que al aumentar la temperatura aumentará su volumen (ley de Charles y Gay-Lussac) y al aumentar la presión el volumen disminuirá (ley de Boyle-Mariotte). Está claro que también dependerá de la cantidad de gas que tengamos: si aumentamos la cantidad de gas, debe aumentar su volumen.

Pero la cantidad de gas que influye no es su masa, sino las moléculas de gas presentes: el número de moles: un mol de gas a 0 ºC y una atmósfera de presión ocupa siempre 22’4 litros, dos moles 44’8 litros etc. Por la ley de los gases sabemos que:
![]()
Si tenemos un mol de gas a 0 ºC (273 K) y 1 atmósfera de presión, ocupa siempre 22’4 l, por lo que sustituyendo en la ecuación anterior nos queda:
![]()
Ese número se denomina constante de los gases ideales y se designa por la letra R. Podemos escribir entonces: ![]() y pasando T al otro miembro de la igualdad
y pasando T al otro miembro de la igualdad ![]() . Y, si indicamos por n el número de moles:
. Y, si indicamos por n el número de moles: ![]()
proceso adiabatico
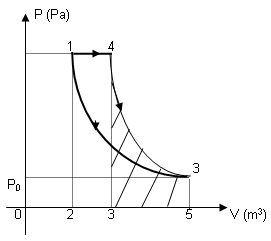
Proceso AdiabáticoUn proceso adiabático es aquel en que el sistema no pierde ni gana calor. Laprimera ley de Termodinámica con Q=0 muestra que todos los cambios en laenergía interna estan en forma de trabajo realizado. Esto pone una limitación al proceso del motor térmico que le lleva a la condición adiabática mostrada abajo. Esta condición se puede usar para derivar expresiones del trabajo realizado durante un proceso adiabático.
La relación entre los calores específicos γ = CP/CV, es un factor en la determinación de la velocidad del sonido en un gas y otros procesos adiabáticos, así como esta aplicación a los motores térmicos. Esta proporción γ = 1,66 para un gas monoatómico ideal y γ = 1,4 para el aire, el cual es predominantemente un gas diatómico. |

citado de
http://hyperphysics.phy-astr.gsu.edu/hbasees/thermo/adiab.html
http://www.juntadeandalucia.es/averroes/recursos_informaticos/concurso1999/accesit3/gasesideales.htm



Leave a comment